Por ósmosis se conoce al fenómeno de difusión de agua a través de una membrana semipermeable (conocidas también como de permeabilidad diferencial o de permeabilidad selectiva).Ejemplos de ese tipo de membrana son la membrana celular, como así también productos como los tubos de diálisis y las envolturas de acetato de celulosa de algunas salchichas.
La presencia de solutos decrece el potencial de agua de una sustancia, por lo tanto existe más agua por unidad de volumen en un vaso de agua corriente que en el volumen equivalente de agua de mar.
En una célula, que posee organelas y moléculas grandes, la dirección del flujo del agua es, generalmente, hacia el interior de la célula.
La presión osmótica se define como la presión hidrostática necesaria para detener el flujo neto de agua a través de una membrana semipermeable que separa soluciones de composición diferente. La presión osmótica (p) está dada por:
donde p es presión osmótica medida en atmósferas (atm), R la constante de los gases, T la temperatura absoluta y DC la diferencia de las concentraciones de solutos a ambos lados de la membrana.
La presión osmótica es una propiedad de tipo coligativa, es decir, depende del número de partículas. Así por ejemplo una solución de NaCl 0,5 M, si estuviera totalmente disociada en Na+ y Cl-, sería equivalente a una solución de glucosa 1M.
 | Las soluciones hipertónicas son aquellas, que con referencias al interior de la célula, contienen mayor cantidad de solutos (y por lo tanto menor potencial de agua). |
 | Las hipotónicas son aquellas, que en cambio contienen menor cantidad de solutos (o, en otras palabras, mayor potencial de agua).
|
Las soluciones isotónicas tienen concentraciones equivalentes de solutos y, en este caso, al existir igual cantidad de movimiento de agua hacia y desde el exterior, el flujo neto es nulo. |
|
|
|
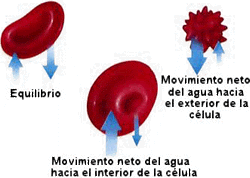 Las células animales se hinchan cuando son colocadas en soluciones hipotónica, algunas como los eritrocitos terminan estallando debido al agua que penetra en ellas por flujo osmótico (se lisan),
Las células animales se hinchan cuando son colocadas en soluciones hipotónica, algunas como los eritrocitos terminan estallando debido al agua que penetra en ellas por flujo osmótico (se lisan),
Una de las principales funciones del cuerpo de los animales es el mantenimiento de la isotonicidad del plasma sanguíneo, es decir un medio interno isotónico. Esto elimina los problemas asociados con la pérdida o ganancia de agua desde y hacia las células. Estamos hablando por supuesto de una de las claves de la homeostasis.
A diferencia de la células animales, las células de bacterias y plantas están rodeadas por una pared celular rígida, en este caso
 | Cuando se encuentran en un medio hipotónico, el agua que penetra por flujo osmótico genera una presión de turgencia que empuja al citosol y la membrana plasmática contra la pared celular. |
 | En cambio en soluciones hipertónicas las células se retraen, separándose la membrana de la pared celular como consecuencia de la pérdida de agua por flujo osmótico (fenómeno conocido como plasmólisis).
|
BIBLIOGRAFÍA
http://www.biologia.edu.ar/cel_euca/transporte.htm
www.educared.net/.../presión_osmótica.htm
www.ehu.es/biomoleculas/agua/coligativas.htm


 Difusión es el proceso mediante el cual las moléculas del soluto tienen a alcanzar una distribución homogénea en todo el espacio que les es accesible, lo que se alcanza al cabo de cierto tiempo (Figura de la izquierda).
Difusión es el proceso mediante el cual las moléculas del soluto tienen a alcanzar una distribución homogénea en todo el espacio que les es accesible, lo que se alcanza al cabo de cierto tiempo (Figura de la izquierda). 


 Para medir la presión osmótica se utiliza el osmómetro (Figura de la derecha), que consiste en
Para medir la presión osmótica se utiliza el osmómetro (Figura de la derecha), que consiste en

